As reações de oxirredução envolvem a transferência de elétrons entre átomos, íons ou moléculas.
Em uma reação de oxirredução ocorrem mudanças no número de oxidação (nox). A oxirredução consiste nos processos de oxidação e redução:
- Oxidação: Resulta na perda de elétrons e aumento do nox.
- Redução: Resulta no ganho de elétrons e diminuição do nox.
Ao mesmo tempo que um elemento cede elétrons, outro irá recebê-los. Assim, o número total de elétrons recebidos é igual ao total de elétrons perdidos.
As reações de oxirredução estão presentes nas mais diversas situações de nosso dia a dia, tais como nas indústrias siderúrgicas, nos processos de respiração e na fotossíntese, nas pilhas e baterias usadas nos equipamentos elétricos, nos processos de corrosão, como o enferrujamento, entre outros
Conforme o elemento que recebe ou doa os elétrons temos as seguintes denominações:
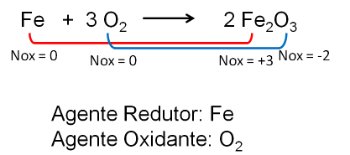
- Agente Redutor: Aquele que sofre oxidação, provoca a redução e aumenta o seu número de nox. É o que perde elétrons.
- Agente Oxidante: Aquele que sofre redução, provoca a oxidação e diminuiu o seu número de nox. É o que ganha elétrons.
O número de oxidação representa a carga elétrica de um elemento no momento em que participa de uma ligação química.
Essa condição é relacionada com a eletronegatividade, que é a tendência que alguns elementos apresentam para receber elétrons.
1. Reação entre o Ferro e o Oxigênio. O oxigênio é mais eletronegativo e acaba por receber elétrons e diminuindo o seu número de oxidação.
ATIVIDADES PRÁTICAS








