As transformações gasosas são aquelas em que se considera uma determinada massa fixa de um gás ideal em um sistema fechado para observar como as variáveis de estado dos gases (pressão, volume e temperatura) inter-relacionam-se. Esse processo é feito por manter constante uma dessas variáveis, enquanto se observa como ocorre a variação das outras duas.
Existem três tipos de transformações gasosas, que ocorrem quando (1) a temperatura permanece constante, (2) quando a pressão permanece constante e (3) quando o volume permanece constante. Vejamos o nome dado para cada uma dessas transformações e quais são as leis que as relacionam:
(1) Transformação isotérmica: Essa palavra vem do grego iso, que significa “igual”, e thermo, que significa “calor”, ou seja, essa é uma transformação gasosa que ocorre com a temperatura constante, enquanto as outras variáveis (pressão e volume) variam. Os cientistas que estudaram a transformação isotérmica foram Robert Boyle e Edme Mariotte, por isso as observações desses estudiosos foram enunciadas em uma lei chamada de lei de Boyle-Mariotte, que diz o seguinte:
“Com a temperatura sendo mantida constante, a massa de determinado gás ocupa um volume inversamente proporcional à sua pressão.”
Isso quer dizer que, se aumentarmos a pressão sobre o gás, o seu volume diminuirá e vice-versa, como a figura a seguir mostra:

Esquema de transformação isotérmica
Duas grandezas são inversamente proporcionais quando o produto entre elas sempre origina uma constante. Assim, temos:
P . V = k
ou
P1 . V1 = P2 . V2
Veja um exemplo a seguir de transformação isotérmica. Observe que o produto entre a pressão e o volume em todos os casos sempre origina o mesmo resultado:
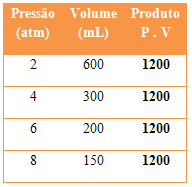
Dados de transformações isotérmicas
Passando os dados das transformações isotérmicas para um gráfico que relaciona a pressão e o volume, obtemos uma hipérbole equilátera, que é chamada de isoterma:
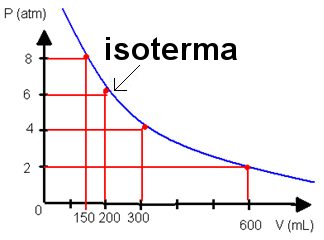
Representação gráfica de uma isoterma
(2) Transformação isobárica: Essa palavra vem do grego iso, que significa “igual”, e baros, que é “pressão”, ou seja, essa é uma transformação gasosa que ocorre com a pressão constante, enquanto as outras variáveis (temperatura e volume) variam.
Os cientistas que estudaram a transformação isobárica foram Joseph Louis Gay-Lussac e Jacques Alexandre César Charles. Por isso, as observações deles foram enunciadas em uma lei chamada de primeira lei de Charles e Gay-Lussac, que diz o seguinte:
“Com a pressão sendo mantida constante, a massa de determinado gás ocupa um volume diretamente proporcional à sua temperatura termodinâmica.”
Isso quer dizer que, se aumentarmos a temperatura do sistema, o volume ocupado pelo gás também aumentará, ou seja, ele expandir-se-á. Por outro lado, com a diminuição da temperatura, o gás contrair-se-á. Veja isso na ilustração a seguir:
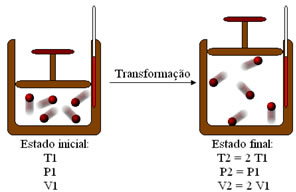
Esquema de transformação isobárica
É importante salientar que as relações expressas em todas as transformações gasosas mencionadas aqui são verdadeiras somente quando se considera a temperatura termodinâmica, ou seja, a temperatura na escala kelvin.
Matematicamente, temos:
V = k
T
ou
V1= V2
T1 T2
Veja um exemplo a seguir de transformação isobárica. Por exemplo, se temos uma massa fixa de um gás em um sistema fechado, sob temperatura de 100 K e seu volume é “V”, se aumentarmos essa temperatura para 200 K, ou seja, se dobrarmos a temperatura, o volume também dobrará, passando para “2V” e assim sucessivamente.
Passando os dados das transformações isobáricas para um gráfico que relaciona a pressão e o volume, obtemos uma reta, conforme o gráfico a seguir mostra:

Representação das transformações isobáricas
(2) Transformação isocórica ou isovolumétrica: Conforme já dito, iso significa “igual”, e coros é “volume”, ou seja, a palavra “isocórica” refere-se a uma transformação gasosa que ocorre com o volume constante, enquanto as outras variáveis (temperatura e pressão) variam.
A segunda lei de Charles e Gay-Lussac diz o seguinte:
“Com o volume sendo mantido constante, a pressão exercida pela massa de determinado gás é diretamente proporcional à sua temperatura termodinâmica.”
Isso quer dizer que, se aumentarmos a temperatura do sistema, a pressão exercida pelo gás também aumentará e vice-versa. Observe:

Esquema de transformação isocórica
Matematicamente, temos:
P = k
T
ou
P1= P2
T1 T2
Portanto, assim como ocorre no caso das transformações isobáricas, nos gráficos das transformações isocóricas, a relação entre a pressão e a temperatura sempre dará uma reta:
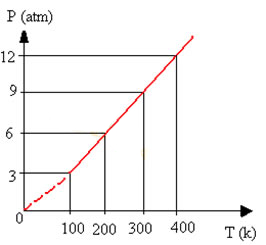
Gráfico de transformação isocórica ou isovolumétrica
Observe que em todos os casos, quando dividimos a pressão pela temperatura termodinâmica respectiva, encontramos o mesmo valor (uma constante):
3/100 = 0,03
6/200 = 0,03
9/300 = 0,03
12/400 = 0,03
Professora Marisa Hass
disciplina: Física
Turma: 2° série EM
Bibliografia
https://mundoeducacao.uol.com.br/quimica/transformacoes-gasosas.htm



